PLTNVLOG e14s02 / sopot (wersja light)
Spisu treści:
Ogromna wiadomość, D-Friends: nowa, szybko działająca insulina, znana jako Afrezza, właśnie uzyskała aprobatę FDA!
Trzeci czas jest urokiem tej nowej formuły insuliny do inhalacji, drugiej w historii, która przeszła przez proces regulacyjny w USA po tym, jak nieudany Exubera Pfizera minęło ponad dekadę temu.
W piątek kalifornijska firma biotechnologiczna MannKind Corp. ostatecznie uzyskała zgodę regulacyjną na urządzenie Afrezza.

Teraz, po ponownym przedłożeniu Afrezzy w październiku 2013 r., MannKind ostatecznie przekonał FDA, że jest gotowa dostać się w ręce dorosłych chorych na cukrzycę!
Najlepsi menedżerowie MannKind mówią nam, że pracują nad znalezieniem partnera farmaceutycznego do produkcji i dystrybucji Afrezza, a produkt mógłby zostać udostępniony zaraz po styczniu lub końcu pierwszego kwartału 2015 r. > W opublikowanym w piątek komunikacie FDA dr Jean-Marc Guettier z Wydziału Metabolizmu i Produktów Endokrynologicznych agencji stwierdza: "Dzisiejsze zatwierdzenie rozszerza możliwości dostępne dla dostarczania insuliny w czasie posiłku do ogólnego leczenia pacjentów z cukrzycą, którzy tego wymagają. kontrolować poziom cukru we krwi. "
Afrezza to ultrakrzepiąca insulina w postaci proszku, która została zaprojektowana jako insulina przed posiłkiem dla dorosłych (jeszcze nie dla dzieci ) z cukrzycą typu 1 lub typu 2. Jego celem jest wzrost poziomu cukru we krwi po posiłku, co oznacza, że jest stosowany w istniejącym leczeniu insuliną i nie jest przeznaczony do samodzielnego leczenia insuliną.
Insulina w proszku jest podawana przez inhalator o nazwie "Dreamboat", który został opracowany po pierwszej rundzie FDA i spowodował opóźnienia, ponieważ agencja chciała więcej badań klinicznych z użyciem tego nowego inhalatora. Proszek rozpuszcza się natychmiast po wdychaniu do płuc, a insulina następnie szybko wrzuca się do krwioobiegu, aby rozpocząć pracę. Szczyty Afrezzy osiągają szczyt w ciągu 12 do 15 minut i są poza układem w ciągu godziny, w porównaniu do obecnych krótkotrwałych insulin, które zwykle trwają co najmniej 20 minut, aby się podnieść, osiągają szczyt w ciągu 2-3 godzin i mogą pozostać w systemie w długie jak pięć godzin.
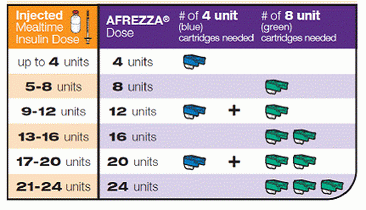
Oczywiście największym wyzwaniem jest to, że nie wymaga żadnych igieł, ale tylko mały ręczny inhalator, który naprawdę wygląda jak gwizdek.Łódź masztowa ma zostać wyrzucona po 15 dniach, aby zapobiec gromadzeniu się w niej proszku, co mogłoby spowodować zatkanie urządzenia. W przeciwieństwie do tradycyjnej insuliny, nie wymaga chłodzenia, ale raczej jest przechowywany w temperaturze pokojowej. Każda jednorazowa wkładka mieściłaby 4 lub 8 sztuk, a do czasu komercjalizacji Afrezza może istnieć 12-osobowa kaseta.
Oto jak możesz za to dawkować, zamieniając bieżącą dawkę insuliny lub bolus w przyjazną dla Afrezzy dawkę do inhalacji:
Osobiście, nie wydaje mi się, żeby dużo insuliny pokrywało niektóre posiłki, które jem wymagać wyższych dawek … Przejrzałbym całą masę tych małych wkładek. Tak więc dla niektórych PWD urządzenie to może stanowić wyzwanie logistyczne w zakresie łatwego dozowania potrzebnych nam ilości …? Ale z drugiej strony, może to być dobre narzędzie do powalania upartych cukrów o wysokiej zawartości cukru z dawką korekcyjną.
W rozmowie telefonicznej pod koniec piątku, prezes MannKind, Hakan Edstrom powiedział nam, że firma nie sfinalizowała jeszcze żadnych umów z potencjalnymi partnerami w celu producenta i dystrybucji Afrezza. Ale zbliża się i prowadzi rozmowy z wieloma firmami, aby jak najszybciej sfinalizować partnerstwo.
Koszty pozostają TBD (wiele zależy od potencjalnego partnerstwa), ale Edstrom mówi, że spodziewają się, że ceny będą w tym samym zakresie, co pacjenci zwykle płacą teraz za pióra insulinowe w USATa aprobata jest OGROMNYM rozwojem i minęło dużo czasu, osiem lat od rozpoczęcia tej misji przez Alfreda Manna - człowieka, który założył Minimed, zanim ostatecznie został kupiony przez firmę Medtronic. Od lat śledzimy historię Afrezzy w "
Mina - od początkowych dni FDA, kiedy MannKind miał swój początkowy, ostrzejszy projekt, do bardziej aktualnych informacji o tym, jak Afrezza jest używana w Sztucznej Trzustce Badania kliniczne.
Przed ponownym zgłoszeniem się FDA z jesieni ubiegłego roku, słyszeliśmy, jak MannKind przechwalał się swoimi studiami klinicznymi III fazy zeszłego lata, które obejmowały ponad 500 PWD typu 1 w Stanach Zjednoczonych i na całym świecie, co wskazywało, że firma była gotowa spróbować ponownie z FDA.
rnn o bezpieczeństwie i skuteczności produktu. Początkowo obawiano się, że długotrwałe narażenie płuc na insulinę może powodować raka płuc, ponieważ dane z badań klinicznych wykazały więcej przypadków raka płuc wśród osób, które otrzymały produkt Afrezza niż inne grupy kontrolne. Ale liczby były małe i dalekie od ostatecznych, a MannKind był zobowiązany do przeprowadzenia długoterminowego badania w celu oceny tego ryzyka.

Aprobując Afrezzę, FDA przydzieliło szereg zaleceń dotyczących bezpieczeństwa, skuteczności i stosowania u pacjentów:
Nie jest zalecane dla osób chorujących na cukrzycę, które palą, ani na cukrzycową kwasicę ketonową (DKA).
- Afrezza jest zatwierdzona tylko dla dorosłych, nie dla dzieci. Jednak agencja prosi o badanie kliniczne po wprowadzeniu do obrotu w celu oceny bezpieczeństwa i stosowania u dzieci.
- FDA wymaga boksowanego ostrzeżenia, doradzając, że niektórzy ludzie z astmą i przewlekłą obturacyjną chorobą płuc (POChP), którzy używali Afrezza doświadczyli ostrego skurczu oskrzeli. W związku z tym osoby z przewlekłą chorobą płuc, astmą lub POChP nie powinny stosować leku Afrezza ze względu na to ryzyko. Najczęstszymi działaniami niepożądanymi związanymi z Afrezzą w badaniach klinicznych były hipoglikemia, kaszel, ból gardła lub podrażnienie.
- Częścią wymagań dotyczących zatwierdzania jest strategia oceny i ograniczania ryzyka, która musi zawierać plan komunikacji mający na celu poinformowanie pracowników służby zdrowia o poważnym zagrożeniu ostrym skurczem oskrzeli związanym z Afrezzą. Oznacza to, że korzyści przewyższają potencjalne ryzyko związane z użyciem Afrezza.
- Wymagane są inne badania po wprowadzeniu do obrotu dotyczące leku Afrezza, takie jak: badanie kliniczne w celu oceny potencjalnego ryzyka wystąpienia nowotworu płuc podczas jego stosowania (badanie to będzie również oceniać ryzyko sercowo-naczyniowe i długofalowy wpływ leku Afrezza na czynność płuc); oraz dwa badania kliniczne farmakokinetyczno-farmakodynamiczne glikemii glukozowej, z których jedna opisuje charakterystykę dawka-odpowiedź, a druga charakteryzuje zmienność wewnątrz osobnika.
- Edstrom powiedział nam, że planują rozpocząć badania pediatryczne tak szybko, jak to możliwe, które realistycznie rozpoczną się w połowie 2015 roku. Oznacza to, że Afrezza może nie zostać zatwierdzona dla dzieci chorych na cukrzycę do 2017 r., A procedura regulacyjna może być różna w zależności od tego, co w międzyczasie pokazują badania po wprowadzeniu leku na rynek i doświadczenie dla dorosłych.
Pomimo zielonego światła FDA, nie ma żadnej gwarancji, że Afrezza odniesie sukces komercyjny, lub że PWD będą gromadzić się, by z niego korzystać. Jak już wspomniano, MannKind nie zabezpieczył jeszcze żadnych partnerów farmaceutycznych gotowych do sprzedaży Afrezzy. Ale jeśli zarobki MannKinda w maju będą świadczyć o tym, co będzie wkrótce, potencjalne partnerstwo może nie być dalekie.
Z punktu widzenia inwestora, wielu jest sceptycznie nastawionych na podstawie nieudanej insuliny wziewnej Exubera, która ukształtowała wiele dyskusji na temat Afrezzy w ciągu ostatnich kilku lat. Ten wspólny produkt Pfizer-Sanofi został wycofany z rynku w 2007 r. Po ponad rocznej wartości sprzedaży poniżej wartości nominalnej - w wyniku czego osiągnięto rekordowe 2 USD. 8 miliardów strat dla dostawców.
Oczywiście, MannKind twierdzi, że Afrezza jest znacząco różna, głównie dlatego, że Exubera używał przylegającego do stopy inhalatora i był powiązany z wyższym ryzykiem raka płuc, którego Pfizer po prostu nie mógł przezwyciężyć.
Zobaczymy, co D-społeczność myśli teraz z Afrezzą, zwłaszcza ze wszystkimi uwagami z badań klinicznych AP, które ostatnio miały miejsce. Czy to wystarczy, by przekonać masę, jest jeszcze niejasne …
Inhalujcie wiadomości na ten temat, a zobaczymy, ile czasu zajmie nam wydychanie i przekształcenie tego podniecenia w rzeczywistą sprzedaż i powszechne użycie.
Zastrzeżenie
: Treść stworzona przez zespół Diabetes Mine. Aby uzyskać więcej informacji, kliknij tutaj. ZastrzeżenieTa treść została stworzona dla Diabetes Mine, blogu poświęconego zdrowiu konsumentów skupiającego się na społeczności chorych na cukrzycę. Treści nie są poddawane przeglądowi medycznemu i nie są zgodne ze wskazówkami redakcyjnymi Healthline. Aby uzyskać więcej informacji na temat partnerstwa Healthline z Diabetes Mine, kliknij tutaj.
Wdychana insulina Afrezza otrzymała zgodę FDA

FDA zatwierdziła nowy wziewny produkt insuliny. Afrezza jest insuliną ultrakrótko działającą w postaci proszku, zaprojektowaną jako pre-posiłek dla diabetyków typu 1.
Insulina wdychana i Afrezza: Co powinieneś wiedzieć

DiabetesMine wyjaśnia historię insuliny do inhalacji na cukrzycę, status Afrezza i więcej.
Insulina wdychana Zatwierdzona przez FDA: Mówiąc o OC?




